资料已备好,还不行动起来!(点击标题下蓝色字:自主招生,关注获取更多精彩内容)
第一章、化学反应与能量
考点1:吸热反应与放热反应
1、吸热反应与放热反应的区别
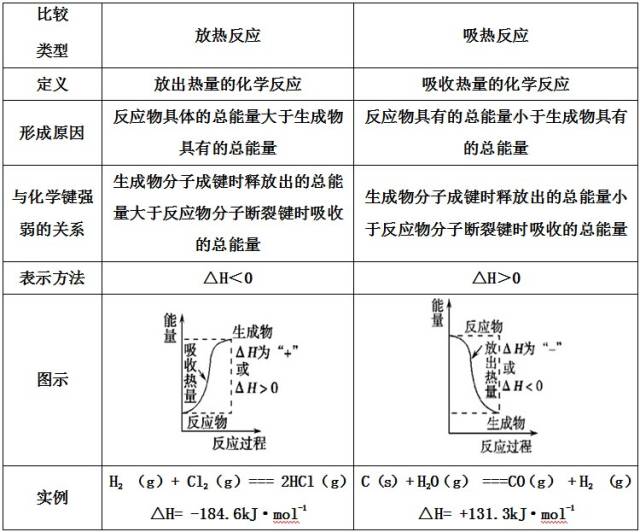
特别注意:反应是吸热还是放热与反应的条件没有必然的联系,而决定于反应物和生成物具有的总能量(或焓)的相对大小。
2、常见的放热反应
①一切燃烧反应;
②活泼金属与酸或水的反应;
③酸碱中和反应;
④铝热反应;
⑤大多数化合反应(但有些化合反应是吸热反应,如:N2+O2=2NO,CO2+C=2CO等均为吸热反应)。
3、常见的吸热反应
①Ba(OH)2·8H2O与NH4Cl反应;
②大多数分解反应是吸热反应
③等也是吸热反应;
④水解反应
考点2:反应热计算的依据
1.根据热化学方程式计算
反应热与反应物各物质的物质的量成正比。
2.根据反应物和生成物的总能量计算
ΔH=E生成物-E反应物。
3.根据键能计算
ΔH=反应物的键能总和-生成物的键能总和。
4.根据盖斯定律计算
化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。即如果一个反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。
温馨提示:
①盖斯定律的主要用途是用已知反应的反应热来推知相关反应的反应热。
②热化学方程式之间的“+”“-”等数学运算,对应ΔH也进行“+”“-”等数学计算。
5.根据物质燃烧放热数值计算:Q(放)=n(可燃物)×|ΔH|。
第二章、化学反应速率与化学平衡
考点1:化学反应速率
1、化学反应速率的表示方法___________。
化学反应速率通常用单位时间内反应物浓度和生成物浓度的变化来表示。表达式:___________ 。
其常用的单位是__________ 、 或__________ 。
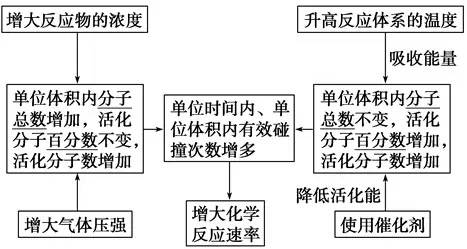
2、影响化学反应速率的因素
1)内因(主要因素)
反应物本身的性质。
2)外因(其他条件不变,只改变一个条件)

3、理论解释——有效碰撞理论
(1)活化分子、活化能、有效碰撞
①活化分子:能够发生有效碰撞的分子。
②活化能:如图
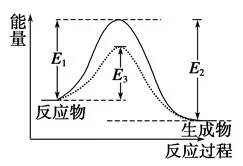
图中:E1为正反应的活化能,使用催化剂时的活化能为E3,反应热为E1-E2。(注:E2为逆反应的活化能)
③有效碰撞:活化分子之间能够引发化学反应的碰撞。
(2)活化分子、有效碰撞与反应速率的关系
考点2:化学平衡
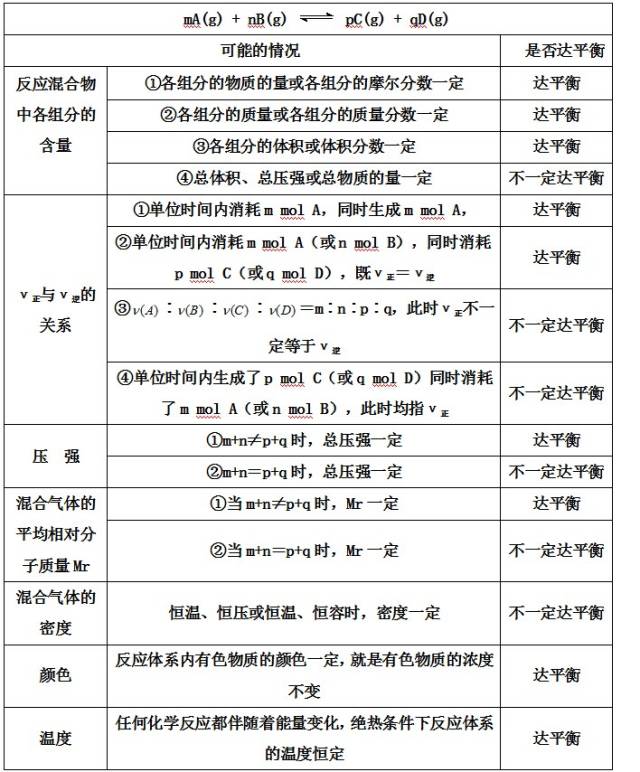
1、化学平衡状态:一定条件(恒温、恒容或恒压)下的可逆反应里,正反应和逆反应的速率相等,反应混合物(包括反应物和生成物)中各组分的浓度保持不变的状态。
2、化学平衡状态的特征

3、判断化学平衡状态的依据
考点3:化学平衡的移动
1、概念
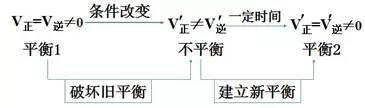
#p#分页标题#e#
可逆反应中旧化学平衡的破坏、新化学平衡的建立,由原平衡状态向新化学平衡状态的转化过程,称为化学平衡的移动。
2、化学平衡移动与化学反应速率的关系
(1)v正>v逆:平衡向正反应方向移动。
(2)v正=v逆:反应达到平衡状态,不发生平衡移动。
(3)v正<v逆:平衡向逆反应方向移动。
3、影响化学平衡的因素
4、“惰性气体”对化学平衡的影响
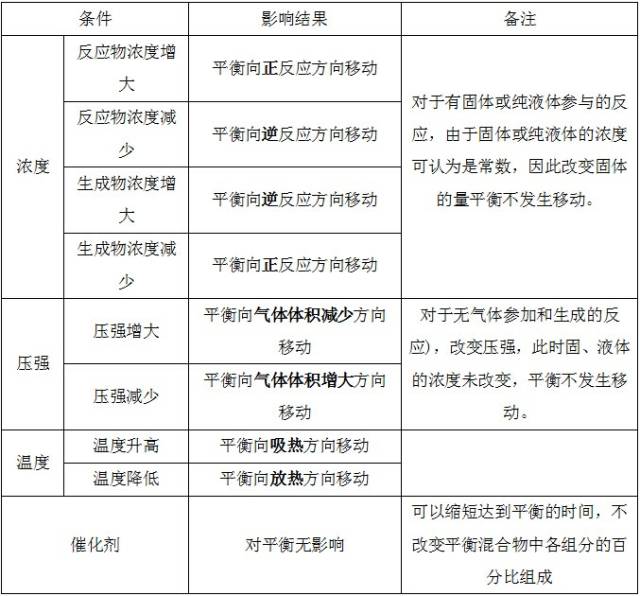
①恒温、恒容条件
原平衡体系体系总压强增大―→体系中各组分的浓度不变―→平衡不移动。
②恒温、恒压条件
原平衡体系容器容积增大,各反应气体的分压减小―→体系中各组分的浓度同倍数减小
5、勒夏特列原理
定义:如果改变影响平衡的一个条件(如C、P或T等),平衡就向能够减弱这种改变的方向移动。
原理适用的范围:已达平衡的体系、所有的平衡状态(如溶解平衡、化学平衡、电离平衡、水解平衡等)和只限于改变影响平衡的一个条件。
勒夏特列原理中“减弱这种改变”的解释:外界条件改变使平衡发生移动的结果,是减弱对这种条件的改变,而不是抵消这种改变,也就是说:外界因素对平衡体系的影响占主要方面。
高考君,自主招生及艺考方向资深老师,运营自主招生及艺考微信公众号.每日政策资讯解读、高考精选学科知识、学霸经验分享等精编内容,发布于微信公众号、今日头条、一点资讯、搜狐等众多主流平台,解决广大高考学子、家长在自主招生及艺考方向的众多疑问,受到广大学子及家长的一致好评。
【简单学习网高二】 精品试学课 / 名师直播 / 优惠券 免费领取
注册